根據國際癌症研究機構(IARC)的數據,癌症仍是全球主要死亡原因之一。2022 年,全球估計有 2000 萬例新發病例與 970 萬例死亡。近期,兩項刊登於《美國化學學會期刊》(Journal of the American Chemical Society, JACS)的新研究,深入探討了與癌症息息相關的人類 β-1,3-半乳糖基轉移酵素 5(β3GalT5)。該酵素負責生產一類與腫瘤生長和轉移密切相關的醣神經胺醇脂系列,包括 SSEA-3、SSEA-4 和 Globo-H,因而成為新型癌症療法與疫苗研發的重要靶點。
此研究由中央研究院基因體研究中心翁啟惠前院長與馬徹研究員領導,團隊透過結構生物學與酵素工程的結合,揭開 β3GalT5 的運作機制與潛在治療應用。這兩篇論文在三月25日的美國化學會的新聞稿有特別介紹(‘Low-sugar’ vaccine can provide broad immunity against coronavirus variants)並發表在這一期的C&EN News 上。
在首篇題為《人類半乳糖基轉移酵素 β3GalT5 的結構機制與特異性》的研究中,研究團隊運用 X 射線晶體學技術,描繪出 β3GalT5 在催化週期中的三維結構。研究結果揭示,該酵素可透過 SN2 類催化機制,與具有強受體的受質結合,驅動醣苷鍵形成。當缺乏強受體時,β3GalT5 則可能透過緩慢的 SN1 類機制進行水解。值得一提的是,該酵素具備廣泛的受質特異性,可修飾多種受體分子,這雖增加了作為藥物標靶的挑戰性,但同時擴展了其應用潛力。這些機制的深入了解,為未來開發針對 β3GalT5 的抑制劑奠定了堅實基礎。
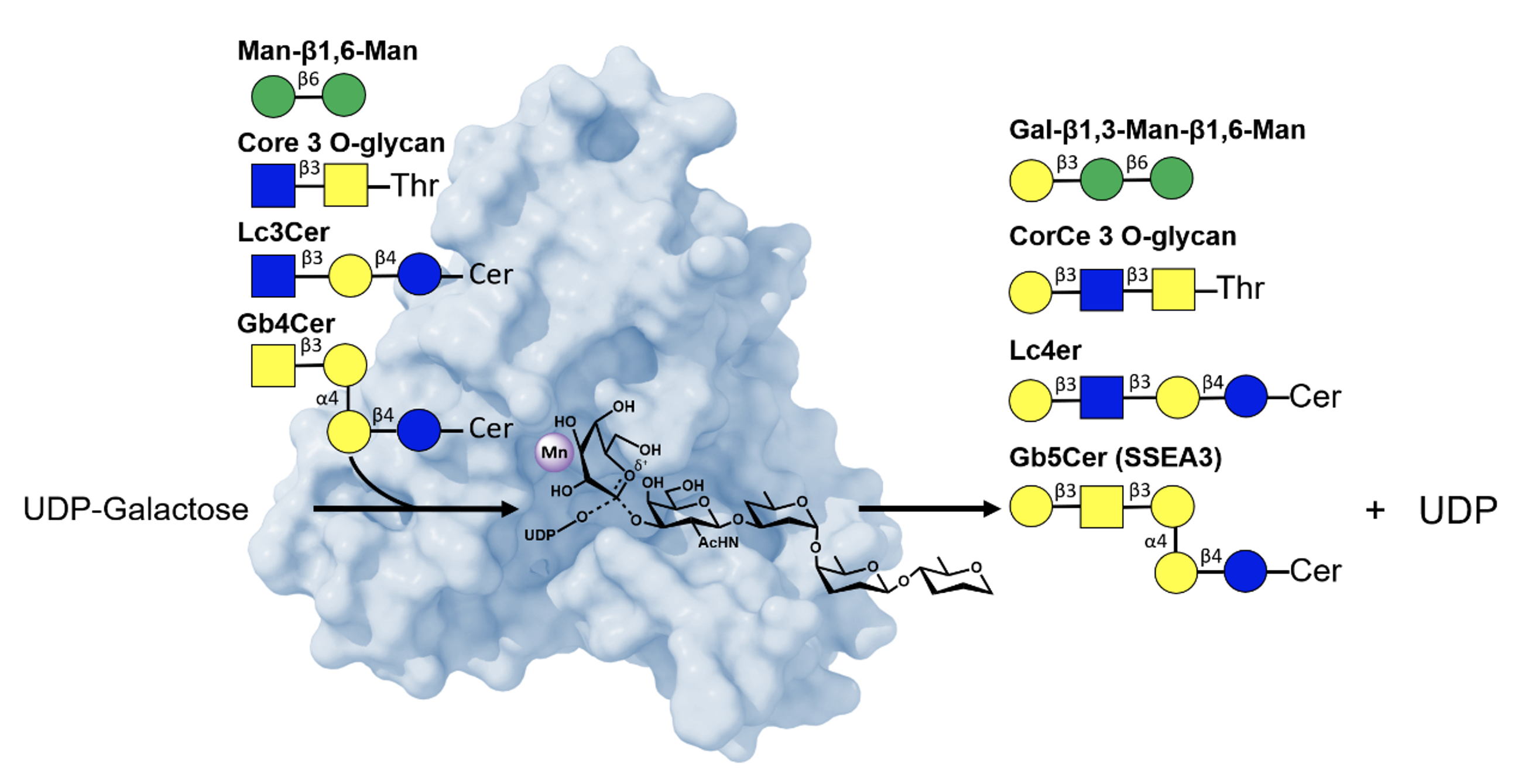 |
| 圖 1. β3GalT5 的催化機制與受質特異性結構圖 |
第二篇研究《在昆蟲細胞中表達人類 β3GalT5-1,以有效合成癌症相關 Globo 系列聚醣》,則聚焦於應用層面。團隊比較了 β3GalT5 的兩種異構體,發現 β3GalT5-1 在乳腺癌細胞中的活性遠高於 β3GalT5-2,而且兩者皆需有三個部位經過醣化後才有活性,這一發現已通過靶向探針和Dicer酶受質 siRNA 實驗獲得驗證。透過昆蟲細胞系統表達 β3GalT5-1 的可溶結構域,並結合 3D 結構導引的位點特異性丙氨酸突變掃描,研究團隊成功找到一個突變體 — S66A,該變體在生產癌症相關醣分子(如 Globo-H)的效率上提升了十倍。這項突破不僅有助於降低疫苗生產成本,亦有望加速針對已在進行後期臨床試驗的三陰性乳腺癌、耐藥性肺癌和食道癌等癌症的臨床應用。
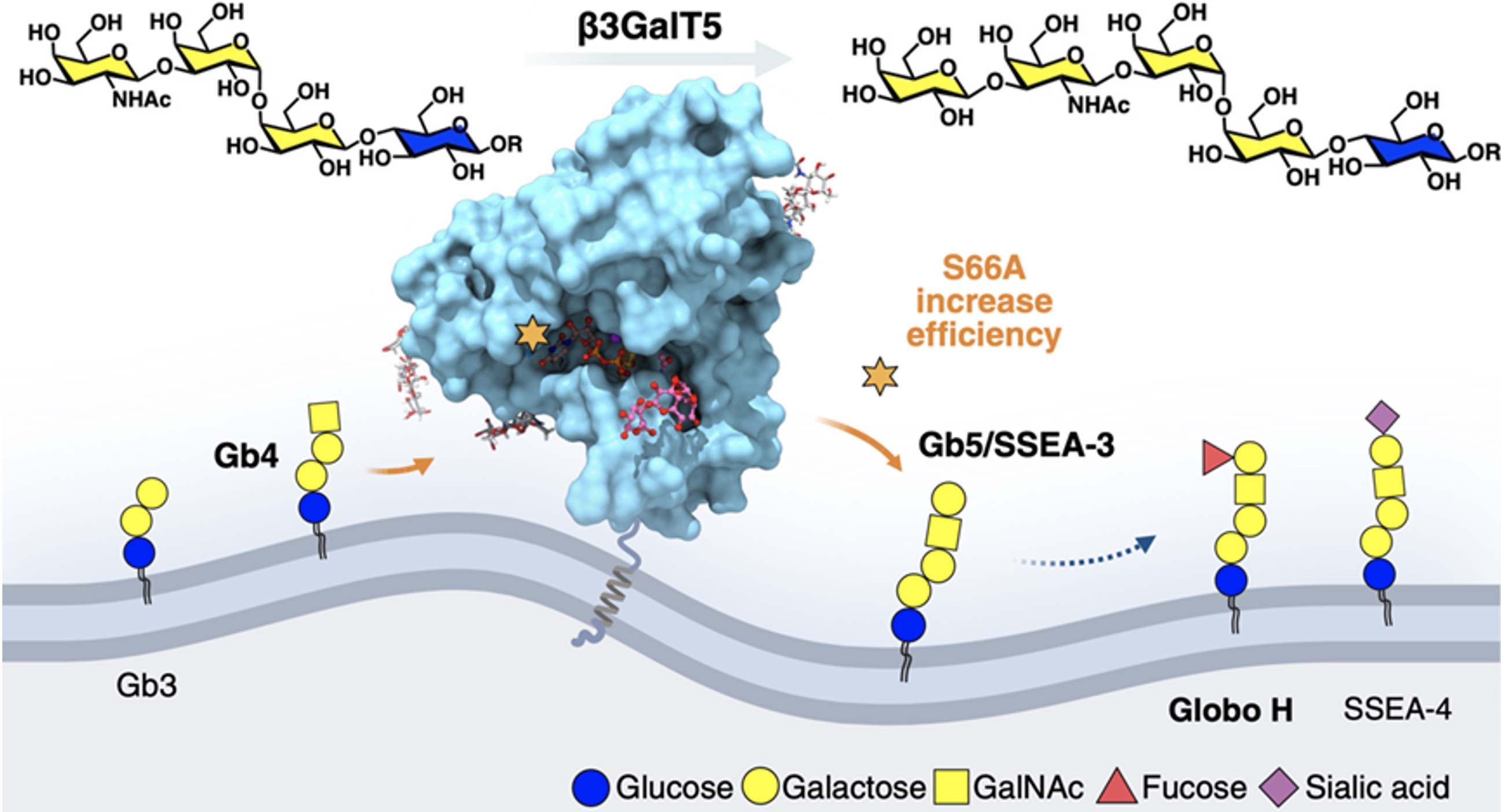 |
| 圖 2. S66A β3GalT5 突變體提升 Globo 系列聚醣的催化效率 |
這兩項研究展示了基礎科學如何轉化為臨床應用的潛力,突顯 β3GalT5 作為藥物開發靶點及合成癌症相關聚醣工具的重要性。透過對該酵素結構與功能的全面解析,科學家們為未來癌症免疫療法和創新治療策略開闢了新途徑。
上述研究由羅婕玲博士與龔治銓先生為共同第一作者,全文可於下方連結閱讀: